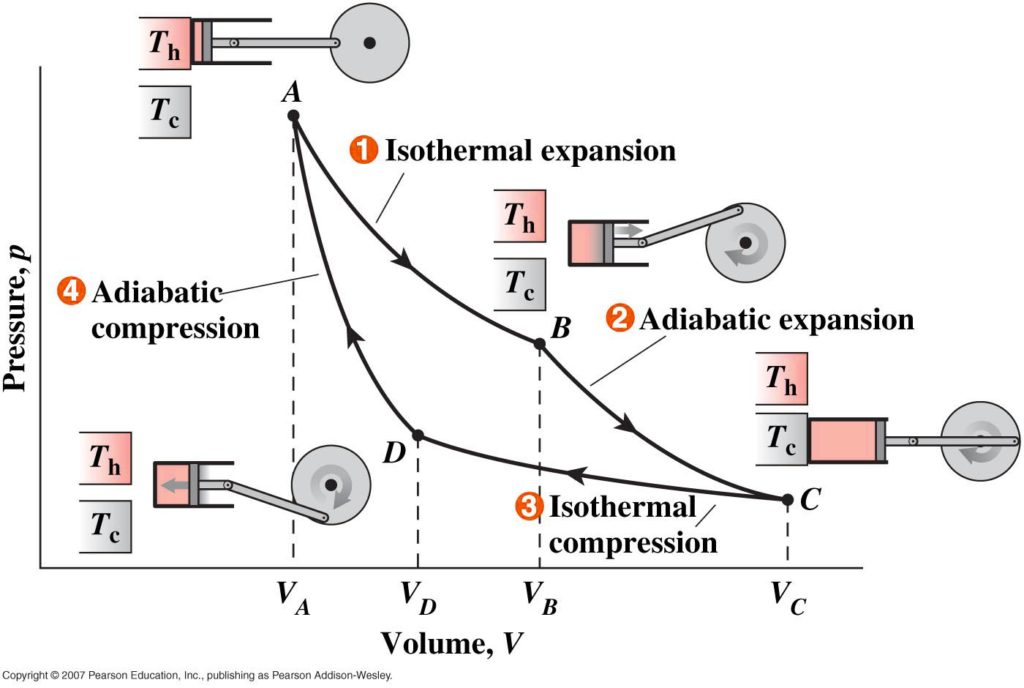
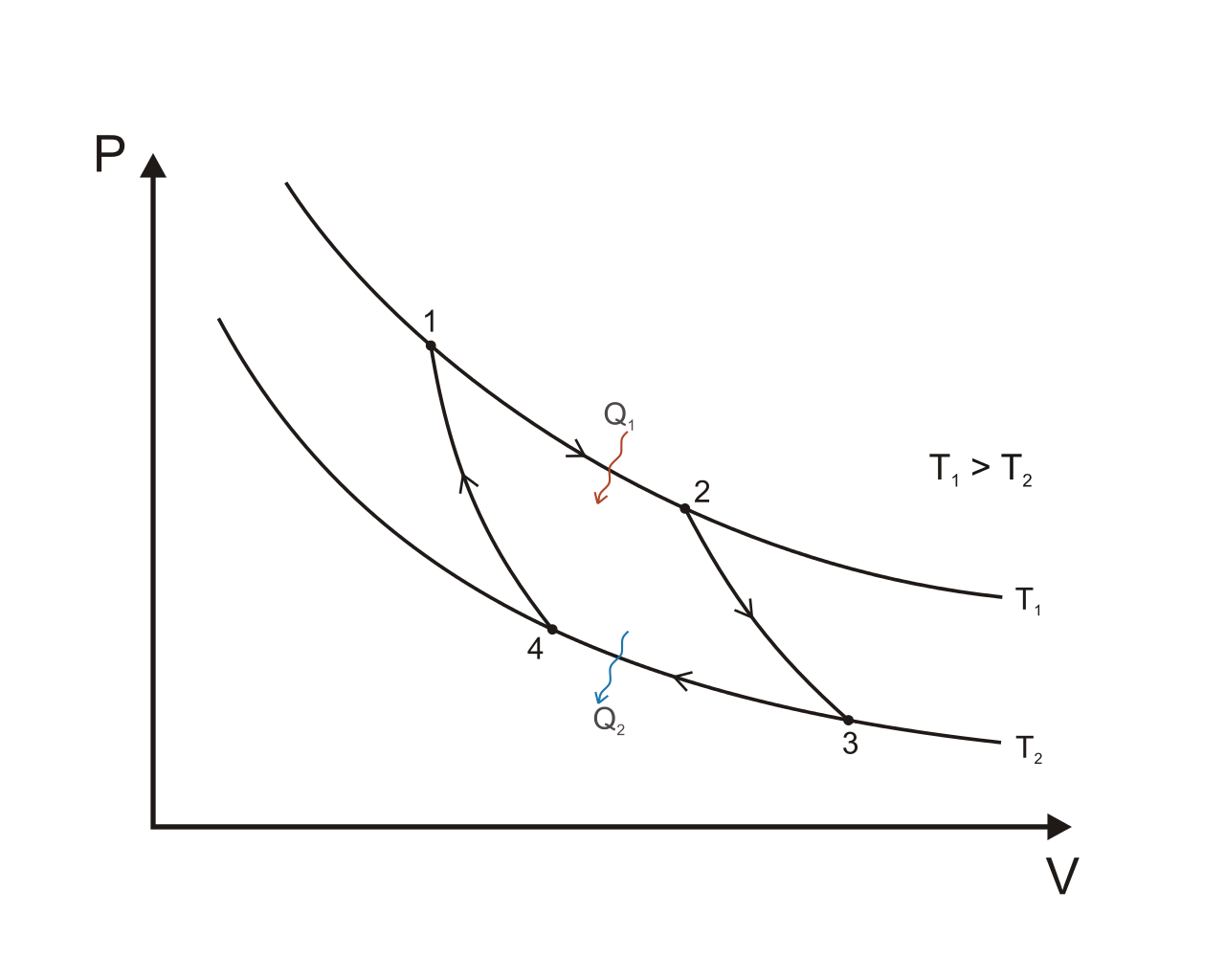
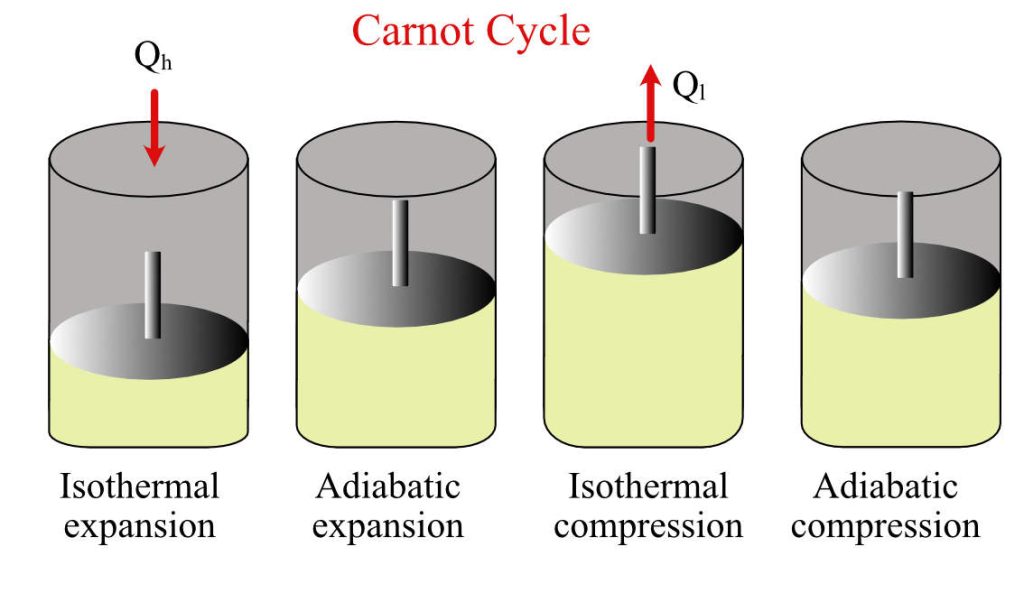
Le cycle de Carnot est un cycle thermodynamique théorique pour un moteur ditherme, constitué de quatre processus réversibles : une détente isotherme réversible, une dilatation adiabatique réversible (donc isentropique), une compression isotherme réversible, et une compression adiabatique réversible.
Quand il est moteur, il s'agit du cycle le plus efficace pour obtenir du travail à partir de deux sources de chaleur de températures constantes, considérées comme des thermostats. Il est alors décrit dans le sens des aiguilles d'une montre dans un diagramme de Clapeyron ou un diagramme de Watt. Le cycle inverse (parcouru dans le sens inverse des aiguilles d'une montre) est le moyen le plus efficace de transférer de l'énergie thermique d'une source froide à une source chaude grâce à un travail.
L'efficacité des autres cycles et des machines réelles est comparée à celle du cycle de Carnot par le biais du rendement, un nombre sans dimension compris entre 0 (efficacité nulle) et 1 (efficacité parfaite).
Historique
Le cycle fut publié par Sadi Carnot en 1824 dans son unique ouvrage Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance et permit d'ouvrir la voie à la formulation du deuxième principe de la thermodynamique.
Aucun moteur cherchant à reproduire ce cycle (même de façon imparfaite) n'a jamais été construit et utilisé concrètement. Les moteurs réels suivent d'autres cycles thermodynamiques, dont certains sont également réversibles et ainsi pourraient atteindre eux aussi le rendement maximum permis par le théorème de Carnot.[réf. souhaitée]
Description
Carnot cherchait à définir le cycle de meilleure efficacité possible. Ainsi l'efficacité de toute machine thermodynamique peut être comparée avec l'efficacité du cycle de Carnot. C'est un cycle théorique : en effet, le cycle étant réversible, il s'effectue en l'absence de phénomènes dissipatifs, et de façon quasi-statique, et n'est donc pas un cycle réel (voir notamment la notion de réversibilité thermodynamique).
Le cycle est composé de quatre transformations successives (les lettres A B C D se rapportent aux diagrammes) :
- Compression isotherme réversible (C→D) / (3→4) (respectivement sur la figure du haut et la figure du bas) ;
- Compression adiabatique réversible (D→A) / (4→1) ;
- Détente isotherme réversible (A→B) / (1→2) ;
- Détente adiabatique réversible (B→C) / (2→3).
Le deuxième principe de la thermodynamique permet d'établir pour une transformation réversible (pour laquelle la température à la frontière du fluide est égale à la température de la source) l'égalité de Clausius-Carnot :
avec :
- transfert thermique avec la source froide (en joules) ;
- transfert thermique avec la source chaude (en joules) ;
- température de la source froide, constante (en kelvins) ;
- température de la source chaude, constante (en kelvin).
Efficacité d'un cycle moteur
L'efficacité thermodynamique (ou énergétique) d'un système est définie comme le rapport entre l'énergie utile en sortie de ce système, et l'énergie fournie par les utilisateurs en entrée de ce système. Pour un cycle de Carnot moteur, on a donc :
- .
Pour un cycle de Carnot moteur, l'énergie utile est celle correspondant au travail algébrique fourni par le fluide, compté négativement, et l'énergie reçue par le fluide est l'énergie thermique apportée par la source chaude grâce à un transfert thermique.
Par définition, on obtient donc pour un cycle de Carnot moteur :
- .
Par ailleurs, le premier principe de la thermodynamique appliqué à ce cycle donne :
- .
On obtient donc :
L'égalité de Clausius-Carnot (expression du second principe) affirme que
Ainsi :
On obtient une efficacité . Il est donc impossible d'obtenir une efficacité de 100 %, même pour le cycle de Carnot moteur entièrement réversible, sauf pour le cas irréaliste où : = 0 K.
Efficacité d'une machine frigorifique
Dans le cas d'une machine frigorifique (climatisation, réfrigérateur…), le cycle de Carnot reçoit un travail extérieur et l'utilise pour réaliser un transfert thermique permettant de prendre de l'énergie thermique au milieu que l'on cherche à refroidir, appelé source froide (intérieur d'un réfrigérateur par exemple). L'efficacité d'un tel cycle est donnée par, :
avec :
- le transfert thermique (chaleur) échangé entre la machine et la source froide ;
- le travail total sur le cycle ;
- la température de la source froide ;
- la température de la source chaude.
L’efficacité d’une machine frigorifique de Carnot n’est pas nécessairement inférieure à 1. Elle est d’autant plus grande (et tend vers l’infini) que les températures des sources sont proches l’une de l’autre. Toutes les machines frigorifiques réelles ont une efficacité inférieure à celle de la machine de Carnot correspondante.
Efficacité thermique d'une pompe à chaleur
Dans le cas d'une pompe à chaleur, le cycle de Carnot reçoit un travail extérieur et l'utilise pour apporter de l'énergie thermique au milieu que l'on cherche à réchauffer, appelée source chaude (par exemple, l'intérieur d'une maison). L'efficacité d'un tel cycle est donnée par, :
avec :
- chaleur transférée à la source chaude par la pompe à chaleur ;
- travail total sur le cycle ;
- température de la source froide ;
- température de la source chaude.
Cette efficacité est appelée coefficient de performance ou COP, plutôt que rendement puisque sa valeur est systématiquement supérieure à 1.
La valeur de fournit la limite supérieure du COP de toute pompe à chaleur réelle fonctionnant entre des sources aux températures et .
Notes et références
Notes
Références
Voir aussi
Articles connexes
- Sadi Carnot (1796-1832)
Liens externes
- Animation du cycle de Carnot sur le site univ-lemans.fr.
- Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, analyse de l'ouvrage de Carnot (1824), sur le site BibNum.
Bibliographie
- P.W. ATKINS, Chaleur et désordre, le deuxième principe de la thermodynamique, Belin, 1987.
- Portail de la physique
- Portail de l’énergie